과학을 잘하려면 일상생활에서 호기심을 가지고, 파고들어야 한다.
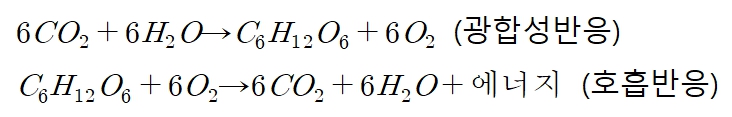
광합성과 호흡 반응은 에너지 출입이 있는 동화작용, 이화작용입니다. 중학교 2학년 생명과학 단원에서 배우는데, 동화작용은 저분자물질을 고분자화합물을 만드는 과정이고, 이화작용은 고분자화합물을 저분자 물질로 만드는 과정입니다. 동화작용에서는 에너지가 흡수되는 흡열반응이 일어나고, 이화작용에서는 에너지가 방출되는 발열반응이 일어납니다.
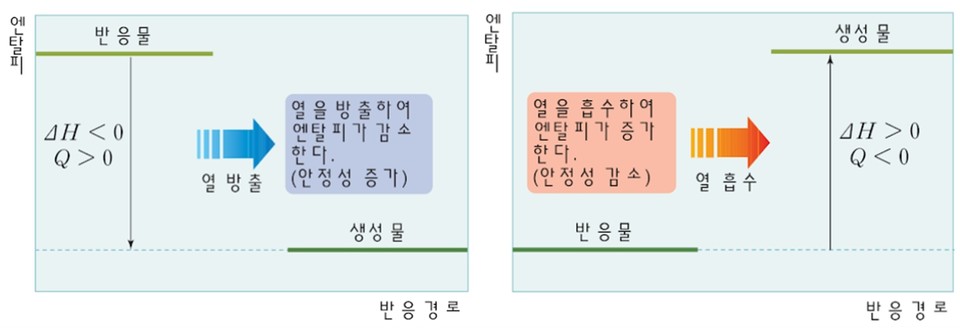
엔탈피는 어떤 물질이 특정온도와 압력에서 가지게 되는 물리량인데, 일반적으로 에너지로 사용됩니다. ΔH는 반응엔탈피를 말하는데, ΔH<0이면 발열반응이고, ΔH>0이면 흡열반응입니다. 엔탈피는 화학II에서 처음 접하지만, 용어를 미리 알고 있는 것도 좋습니다.
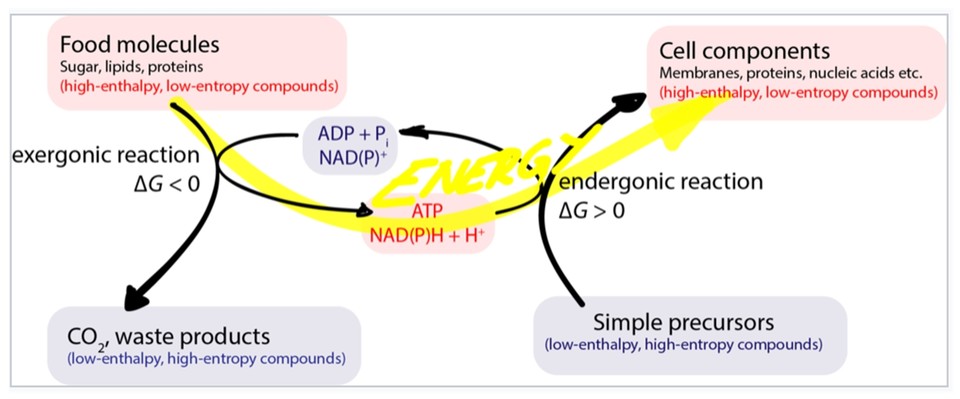
왼쪽은 이화작용으로 발열반응을, 오른쪽은 동화작용으로 흡열반응을 나타낸 것입니다. ΔG는 자유에너지로 반응의 자발성 여부를 예측하는 열역학적 함수입니다. ΔG=ΔH-TΔS(H : 계의 엔탈피, T : 절대온도, S : 계의 엔트로피)이고, ΔG<0이면 반응은 자발적으로 일어나고, ΔG>0이면 반응은 자발적이지 않습니다. ΔG=0 이면 반응은 평형상태입니다. 따라서 발열반응은 자발적이고, 흡열반응은 비자발적임을 알 수 있습니다. 깁스 자유에너지는 화학II단원에서 빠져서 제일 처음 접할 수 있는 교과는 고급화학입니다. 화학II를 공부할 때도 충분히 이해할 수 있는 내용이므로 연계하여 미리 공부하는 것도 도움이 됩니다.
생명과학과 화학은 뗄래야 뗄 수 없는 과목입니다.
생명현상이 일어날 때 반응이 거의 화학반응인 경우가 많기 때문입니다. 특히 물질대사 단원은 화학을 기본적으로 알 수 있어야 내용을 잘 이해할 수 있습니다.
다음은 열역학-물질의변화와 에너지 단원맵입니다. 물리와 많이 연관이 되어있고, 화학전공에서 배우는 물리화학으로 이어집니다.

헤스의 법칙을 물리학 기사 때 열역학 제1법칙인 에너지보존법칙의 한 형태라고 언급을 하였습니다. 헤스의 법칙은 반응물의 종류와 상태, 생성물의 종류와 상태가 같으면 반응 경로에 관계없이 반응엔탈피가 일정하므로, 이미 알고 있는 화학반응식으로 구하기 어려운 화학반응의 엔탈피를 구할 수 있습니다.
고급화학에서는 물리학에서 배웠던 열역학 내용을 다 알아야 이해할 수 있으므로, 화학과 물리학의 연계도 생각하면서 공부해야 특목고 과학을 공부할 때 어렵지 않습니다. 공식을 유도하거나 이해할 때 적분을 알아야 이해할 수 있는 부분이 많이 있으므로, 단원별로 조금 차이는 있지만, 고급화학 역시 고급물리학과 마찬가지로 미적분을 배운 후 공부하는 것이 더 바람직합니다.
일반 화학 실험에서는 열화학 반응에서 반응엔탈피를 측정하는 실험을 하는데, 화학II 내용을 충분히 이해한다면 실험은 어렵지 않을 것입니다.
다음 시간에는 물질의 구조 단원을 중심으로 마인드맵과 공부법에 대해 알아보겠습니다.
경력:
- 유원멘토입시연구소 이공계열 연구소장
- 진로로드맵 특목고 대표 컨설턴트
- EBS강사가 추천하는 인기학과 진로코칭 (로봇·인공지능편) 저자
- 한국교육컨설턴트협의회 진로진학 컨설턴트